分子(molecule)是能保持物質特有化學性質,且能獨立存在的最小電中性·粒子。分子一般由兩個或更多原子(atom)通過共價鍵(covalent bond)形成,但亦有學者認為由一個原子組成的惰性氣體(Noble gas),也是分子,稱為「單原子分子」。

而原子核僅為示意,質子以粉紅色、中子以紫色表示。
(對於更複雜的原子核則非如此)
化學元素
化學元素(chemical element)是構成物質(matter)的基本單位,簡稱:元素;同一種化學元素是由質子(proton)數相同的原子(atom)組成,無法直接用「化學方法」分解,透過化學反應途徑分解為更小單位,是一種純物質。直至現在地球上已被定義的有 120種基本的金屬和非金屬純物質。參考:元素週期表。
元素符號
元素符號(element symbols)為化學元素的符號,是由一個或兩個拉丁字母(Latin script|羅馬字母)組成,且首字母大寫,如:H、C、Cr…等。元素符號方便用來書寫化學式(chemical formula),如:氫氧化鈉可書寫為 NaOH、硫酸鈉可書寫為 Na2SO4。
元素週期表
化學元素(chemical element)是一百多種構成物質的基本單位,不能直接用化學方法分解,也是基本的金屬和非金屬純物質,簡稱:元素(英語:element)。常見元素有 氫、碳、氮、氧、矽、鐵、鋁、硫、鈣和鈉…等。
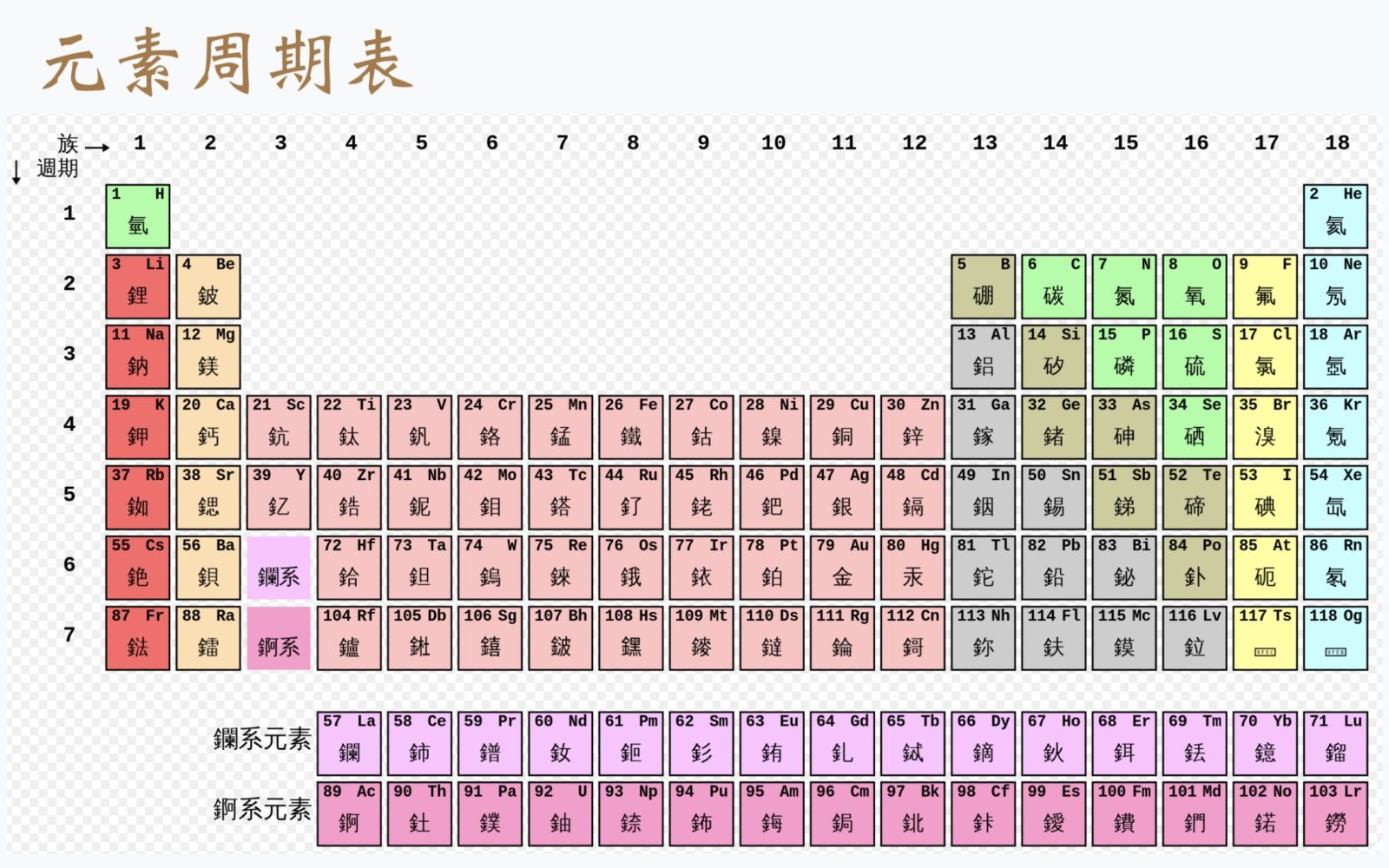
週期表的橫行被稱作週期,縱列則被稱作族。
同位素
同位素(英語:Isotope)是指同一化學元素之下的不同核種,又稱:同位素核種(英語:Isotopic nuclides)。同一種元素的所有同位素都具有相同的質子數目(即原子序數),但中子數目不同,故質量數不同。由於這些核種屬於同一種化學元素,在化學元素週期表佔有同一個位置,因此得名。
目前已知的大多數同位素原子核皆不穩定,具有放射性,會自發性地放出游離輻射並衰變成其他核種,稱為放射性同位素,如:氚、碳-14、鉀-40、鈷-60和碘-131…等。
-
氦(原子量:4.002602)共有 8個已知同位素,質量數介於 3~10之間,其中有 2個是穩定的,其他都具有放射性。天然存在的氦同位素有 2個,分別是 3He和 4He,皆為穩定同位素。其中 3He豐度很低,僅占天然氦的0.000137%。其他放射性同位素(5He到 10He)都不出現在自然界中,只有在實驗室製造出來過,且半衰期都極短,非常不穩定。
-
碳的同位素為化學元素碳(原子量:12.0107(8))的同位素,已知有 15個,質量數介於 8~22之間,其中有 2個是穩定的,其他都具有放射性。碳的天然同位素有 3個是穩定的,分別為 12C、13C和具放射性的 14C,其中 14C在自然界中僅痕量存在,為宇宙射線所產生。其餘同位素都不出現在自然界中,只在實驗室製造出來過,且半衰期都很短,非常不穩定。
原子
原子(atom)是構成化學元素的普通物質的最小單位;原子也是化學變化中最小的粒子及元素·化學性質的最小單位。
- 一粒正原子包含有一粒緻密的原子核及若干圍繞在原子核周圍帶負電的電子。
- 反原子的原子核帶負電,周圍的反電子(電洞)帶「正電」。正原子的原子核由帶正電的質子和電中性的中子組成。反原子的原子核中的反質子(antiproton)帶負電,從而使反原子的原子核帶負電。
- 當質子數與電子數相同時,這原子就是電中性,稱為中性原子(neutral atom)。質子數決定了該原子屬於哪種元素;
- 中子數則確定了該原子是此元素的哪種同位素。
原子實際上擁有很多不同的次原子粒子:電子、質子和中子。氫-1原子和帶一粒正電荷的氫正離子例外,前者沒有中子,後者沒有電子。在物理學標準模型理論中,質子和中子都由名叫夸克的基本粒子構成。夸克是費米子(擁有夸克與輕子)的一種,也是構成物質的兩種基本組分之一。另一基本組份稱輕子,電子就是輕子的一種。
·¡·)費米子可以是基本粒子,如:電子,或是複合粒子,如:質子、中子。
電子
電子(英語:electron)是一種帶有負電的次原子粒子,通常標記為 e– 。相對於中子和質子所組成的原子核(atomic nucleus),電子的質量顯得極小。質子的質量大約是電子質量的 1’836倍。
電子帶有1/2自旋,是一種費米子,根據包立不相容原理,任何兩個電子都不能處於同樣的量子態。電子的反粒子是正子,其質量、自旋、帶電量大小都與電子相同,但是電量正負性與電子相反。電子與正子會因碰撞而互相湮滅,並在這過程中,生成一對以上的光子。
離子
離子(英語:ion)是指原子或分子失去或得到電子而形成的帶電荷的粒子。得失電子的過程稱為電離,電離過程的能量變化可以用電離能來衡量。形成穩定陰離子是放熱反應(exothermic reaction),這部分釋放的能量就稱為電子親和能(electron affinity)。電子親和能越大,原子/分子的得電子就越容易。離子也是構成化學結構的基本粒子,在元素周期表上,VII族原子的電子親合能最大,而惰性氣體的電子親合能最小。
元素週期表是依原子序數、核外電子組態情況和化學性質的相似性來排列化學元素的表格。週期表的橫行被稱作週期,縱列則被稱作族。
- 陰離子(英文:anion或 negative ion)是指中性的原子或分子獲得電子而產生帶負電荷的微觀帶電粒子,不稱為:「負離子」。
- 陽離子(英文:cation或 positive ion)是指中性的原子或者分子失去電子,而產生的帶正電荷的微觀帶電粒子,不稱為:「正離子」。
酸鹼值
氫離子濃度指數(拉丁文:pondus hydrogenii)又稱:pH值、酸鹼值,是溶液中氫離子·活度的一種標度,也是衡量溶液酸(氫正離子)、鹼(氫氧根離子)程度的最普遍標準。概念在1909年由丹麥·生物化學家·瑟倫·索倫森(丹麥語:Søren Peder Lauritz Sørensen,1868/01/09~1939/02/12)提出。
·¡·)在 25°C,pH=7的水溶液為中性(如:純水),水在 25°C自然電離出的氫離子和氫氧根離子濃度的乘積(水的離子積常數,Kw)始終是 1×10⁻¹⁴,且兩種離子的濃度都是 1×10⁻⁷M。pH小於 7即 H⁺濃度大於 OH⁻濃度,溶液酸性強,而 pH大於 7則 H⁺濃度小於 OH⁻濃度,溶液鹼性強。是故 pH愈小,溶液愈酸;pH愈大,溶液也就愈鹼。
粒子
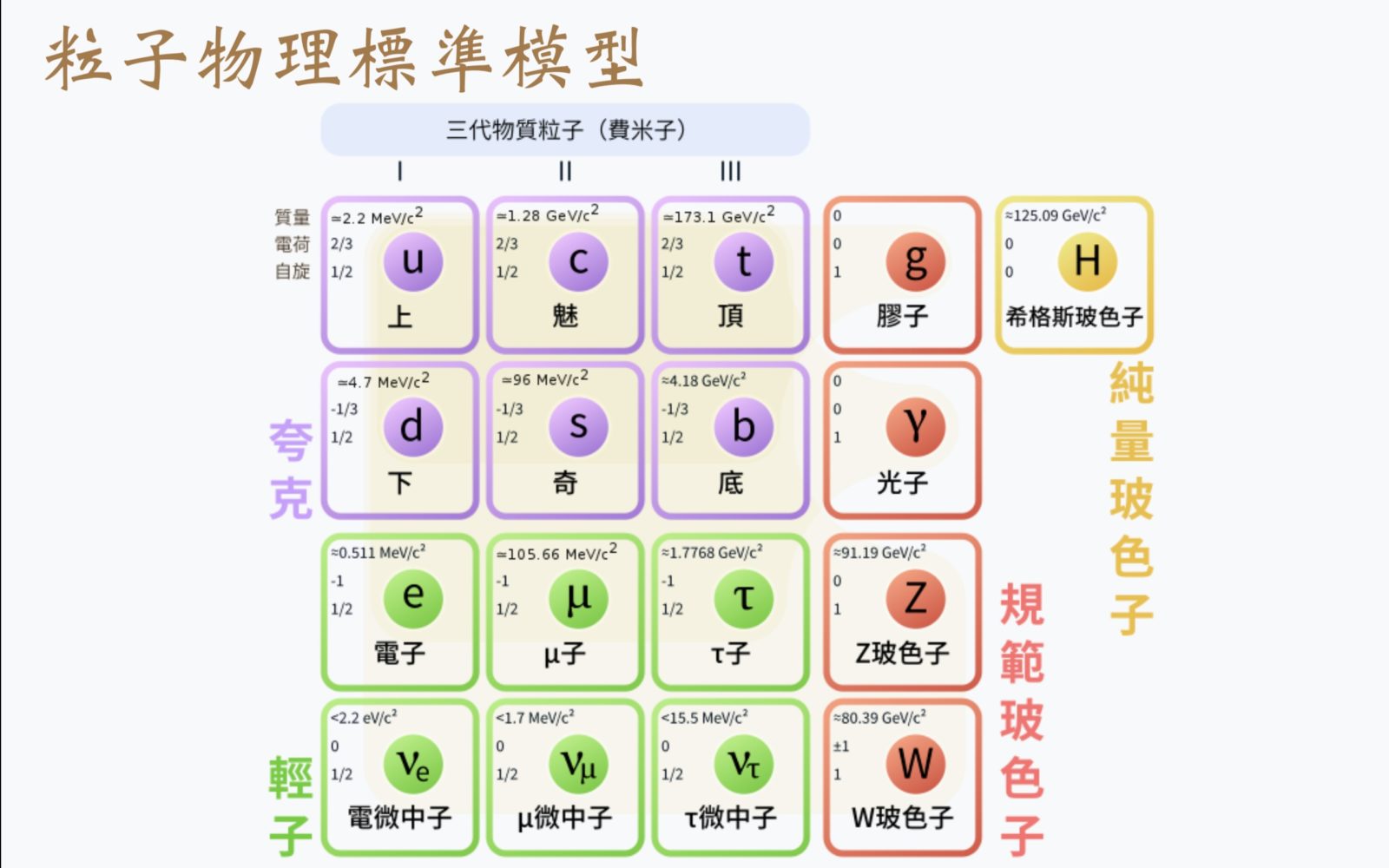
粒子(英語:particle,舊稱:corpuscule)是指占有微小格局的物體,可以被賦予若干物理性質或化學性質,如:體積、密度或質量…等。
- 固體粒子之間的距離很小,且呈規則排列。粒子在確定位置上不停振動,所以固體具有穩固性,有一定的體積和形狀。
- 液體粒子之間的距離比固體的略大,呈不規則的排列,粒子做振動的同時做短距離的自由移動。所以液體具有流動性,有一定的體積,但沒有一定形狀。
- 氣體粒子之間的距離很大,呈不規則排列。粒子可以在空間到處自由活動。
粒子也可以用來創建更大物體的科學模型,這取決於它們聚集的程度,如:在人群中移動的人類或運動的天體。
